SEP et McDonald 2024 : Quand l’imagerie prend une place centrale
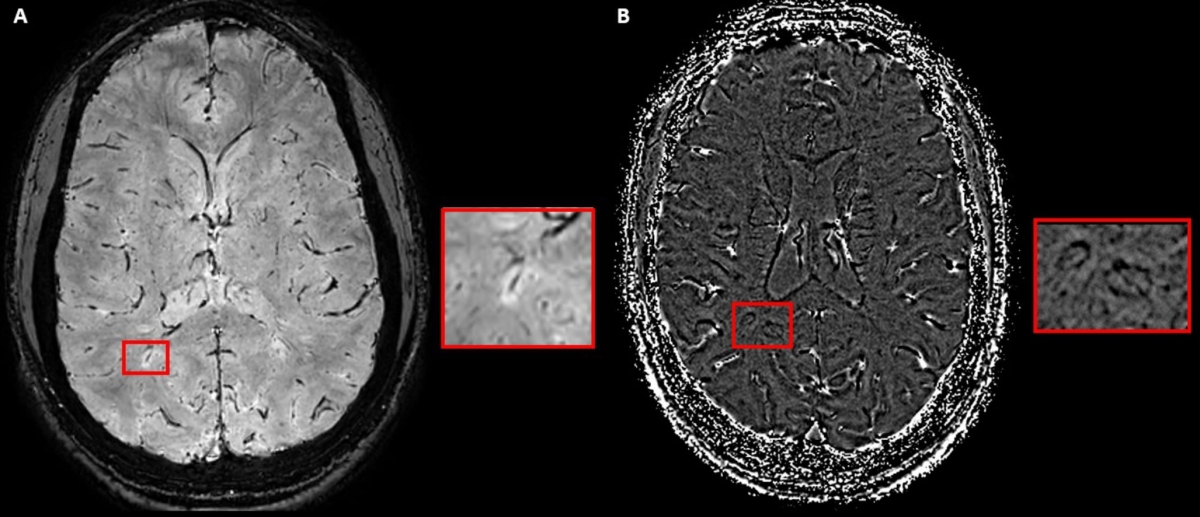
Schéma représentant la mise en évidence d’une veine centrale sur des séquences SWI-EPI en magnitude (A), et d’un PRL en phase (B).
Son diagnostic repose sur des critères cliniques et paracliniques qui ont évolué au fur et à mesure des avancées médicales. Parmi ces critères paracliniques, et depuis les critères de McDonald 2001, l’IRM joue un rôle central. La révision régulière de ces critères a pour but de trouver l’équilibre entre une mise en évidence rapide de la maladie et l’évitement des diagnostics différentiels.
La parution récente des critères de McDonald en 2024-2025 avance dans ce sens : un possible diagnostic précoce permettant une prise en charge rapide des symptômes, tout en restant spécifique de la SEP. Outre les quatre localisations définissant la dissémination spatiale (juxtaventriculaire, juxta-corticale/corticale, sous-tentorielle et médullaire), une cinquième est dorénavant à prendre en compte : le nerf optique. Cette dernière apporte une meilleure sensibilité sans perte de spécificité de diagnostic. Certaines limites étaient présentes avant la révision des critères. Citons par exemple le syndrome radiologique isolé, qui correspond à la présence d’anomalies en imagerie sans symptôme clinique, mais avec un risque d’évolution vers une SEP active cliniquement et radiologiquement. De même, le spectre des maladies démyélinisantes, et donc des diagnostics différentiels, est large.
Pour parfaire ces limites, la révision des critères de McDonald amène deux nouveaux biomarqueurs IRM : la veine centrale (CVS) et l’anneau paramagnétique (PRL). L’étude de ces biomarqueurs se fait sur des séquences SWI. Le consensus de la NAIMS rappelle les critères d’identification de la veine centrale : un hyposignal linéaire ou punctiforme, qui se situe au centre de la lésion, visible dans au moins 2 plans perpendiculaires, et ce, en absence de veines multiples. De même, le PRL (dont l’étude se fait sur les séquences de phase de la SWI) correspond à une couronne linéaire généralement de même signal que le cortex, au pourtour d’au moins 2/3 d’une lésion, visible sur au moins 2 plans, en l’absence d’injection de produit de contraste. Le rôle de ces biomarqueurs devient prépondérant dans la SEP. En effet, lorsque cliniquement un patient montre des symptômes typiques et qu’en imagerie sont retrouvées au moins 2 localisations de dissémination spatiale, alors la présence de six CVS est suffisante pour poser le diagnostic. Si une seule localisation est présente, alors six CVS et un critère de dissémination temporelle ou des anomalies dans le liquide cérébrospinal font le diagnostic. Notons également que la mise en évidence du CVS augmente la spécificité du diagnostic, mais que sa présence n’en est pas moins nécessaire.
De même, lorsqu’un patient démontre des symptômes typiques, une lésion remplissant les critères de dissémination spatiale, alors le PRL, associé à un critère de dissémination temporelle ou aux anomalies du liquide cérébrospinal, permet de poser le diagnostic de SEP. De façon identique au CVS, la présence du PRL augmente la spécificité du diagnostic, mais n’est pas obligatoire.
Enfin, une avancée majeure de ces biomarqueurs est la possibilité de faire découvrir une SEP chez des patients pré-symptomatiques. Lors de la découverte fortuite de lésions dans 2 à 5 localisations, la présence de 6 CVS permet en effet de poser le diagnostic. Pour conclure, la révision des critères de McDonald fait briller la cohésion du couple radiologue/neurologue dans le diagnostic de SEP. L’importance est désormais de se familiariser avec ces nouveaux biomarqueurs et ainsi, améliorer la qualité de vie des patients atteints de SEP.
