Ablation par radiofréquence dans le traitement du carcinome hépatocellulaire en zones à risque et en peropératoire : vers une extension des indications curatives
Les CHC sont considérés comme localisés en zones à risque lorsqu’ils sont situés à moins de 5 mm de structures vasculaires de gros calibre (branches de 1ᵉʳ ou 2ᵉ ordre de la veine porte, veines hépatiques, veine cave inférieure de calibre ≥ 3 mm) ou à proximité d’organes extra-hépatiques (diaphragme, vésicule biliaire, rein droit, cœur, tube digestif). Les lésions sous-capsulaires, en raison de leur exposition superficielle, font également partie de cette catégorie.
Réaliser une RFA dans ces zones présente plusieurs défis :
- La visualisation échographique peut être dégradée, compliquant le guidage précis de l’électrode.
- Le risque de lésion thermique des structures voisines est accru : pneumothorax ou épanchement pleura une proximité avec la vésicule biliaire peut induire une cholécystite ou une fistule biliaire.
- Perforation intestinale ou atteinte rénale thermique pour des lésions juxta tubulaires ou juxta rénales.
- “L’effet puits thermique” (heat-sink) provoqué par les gros vaisseaux adjacents dissipe la chaleur et limite la taille de la zone de coagulation.
Pour pallier ces obstacles, plusieurs stratégies ont été développées :
- Induction d’une ascite artificielle ou d’un épanchement pleural artificiel pour créer un tampon thermique et améliorer la visibilité échographique.
- Positionnement patient adapté et insertion de l’électrode selon un axe optimal (parallèle ou perpendiculaire à la structure critique).
- Technique “no-touch” pour les lésions sous-capsulaires.
- Clampage vasculaire temporaire pour réduire l’effet de dissipation thermique et augmenter la nécrose tumorale.
- Coagulation du trajet d’aiguille au retrait pour limiter saignement et dissémination
- Prélèvement TACE en amont des CHC volumineux juxta-vasculaires afin de réduire le volume tumoral et de faciliter la détection des foyers satellites.
Malgré ces défis, la RFA en zones à risque demeure une alternative valable pour les patients contre-indiqués à la chirurgie ou la refusant.
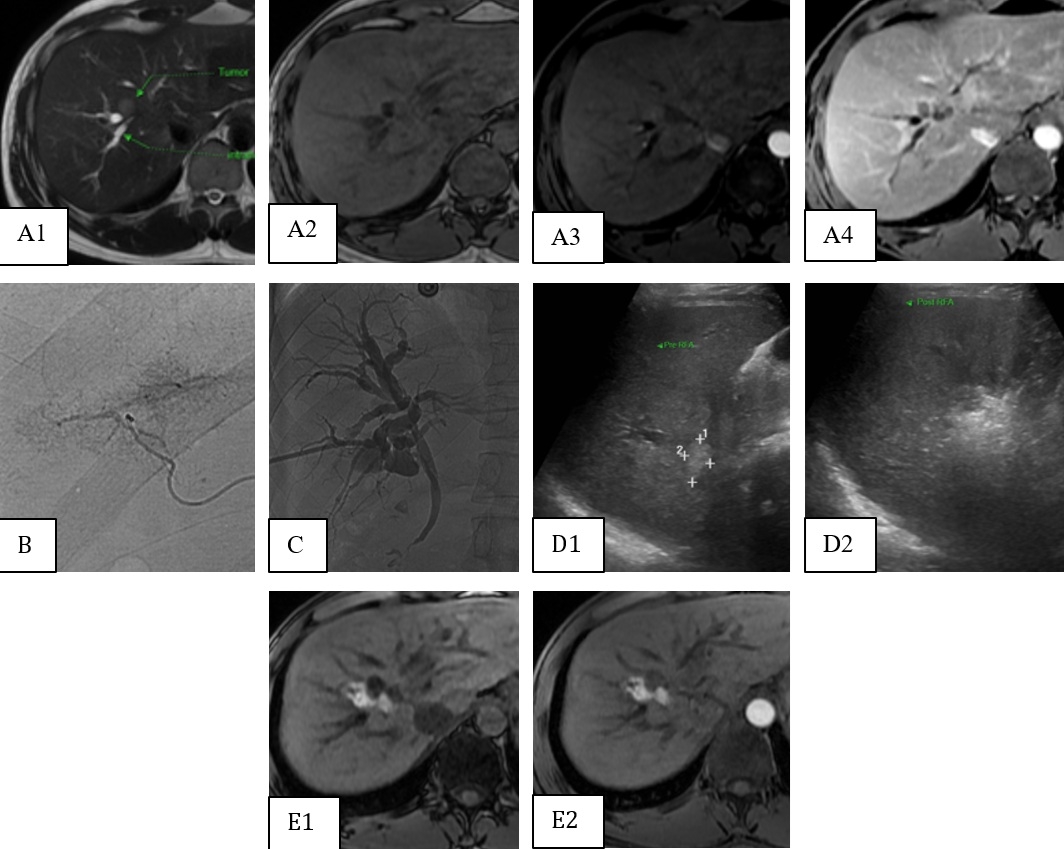
Figure 1 : Homme, 44 ans, hépatite B. Découverte d’une tumeur au foie droite : hypersignal discret en T2 (A1), hyposignal en T1 (A2), hyper-vascularisation en phase artérielle (A3) avec lavage en phase portale (A4). Le patient refuse la chirurgie et TACE non réalisable (B). Mise en place d’un drain biliaire au contact de la tumeur (C), avec infusion biliaire continue et refroidissement pendant la procédure de RFA. L’image d’échographie de tumeur avant (D1) et après la procédure (D2). Ablation complète par RFA sans atteinte des voies biliaires en T1 (E1), absence de rehaussement en phase artérielle (E2).
IO-RFA : une approche peropératoire pour les formes complexes ou multifocales
L’IO-RFA est particulièrement adaptée aux CHC multifocaux répartis sur plusieurs segments ou lobes hépatiques, souvent exclus d’un traitement curatif unique. Elle permet de combiner résection chirurgicale des lésions facilement accessibles et ablation peropératoire des foyers résiduels au cours de la même intervention.
Les avantages principaux sont :
- Accès direct aux lésions via la surface hépatique exposée, facilitant un positionnement précis de l’électrode sous contrôle échographique peropératoire.
- Imagerie peropératoire plus sensible que l’imagerie préopératoire pour détecter les nodules de petite taille et les lésions satellites.
- Mobilisation chirurgicale du foie pour éloigner ou protéger les structures à risque.
- Clampage vasculaire temporaire annulant l’effet puits thermique et optimisant la destruction tumorale.
- Préservation maximale du parenchyme hépatique, essentielle chez les patients cirrhotiques ou à réserve hépatique réduite.
Cependant, cette technique nécessite une laparotomie, engendre un surcroît d’invasivité, un risque opératoire accru et allonge potentiellement la durée d’hospitalisation. Ces éléments doivent être discutés au sein d’une réunion multidisciplinaire.
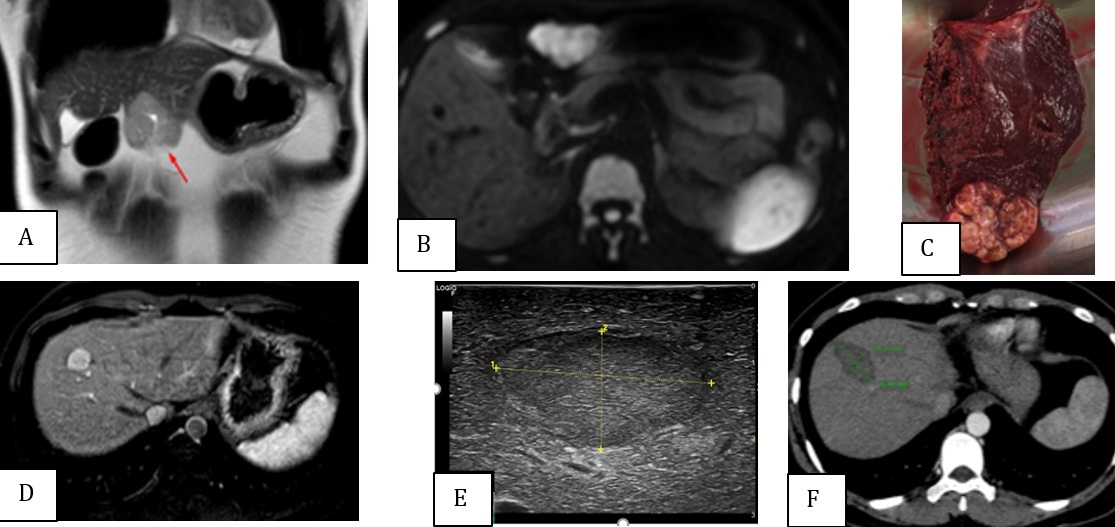
Figure 2 : Femme, 34 ans, hépatites B. Découverte fortuite de deux CHC au segment III, hypersignal en T2 (A) et en DWI (B), et au segment VIII, hypervascularisé en phase artérielle (D). AFP initiale de 2334 ng/ml. Résection de la lésion du segment III (C) et RFA peropératoire de tumeur du segment VIII, sous-échographie (E). Contrôle par TDM après un mois sans rehaussement (G), AFP réduire de 18,07 ng/ml.
Conclusion
La RFA reste une référence pour le traitement curatif du CHC à un stade précoce. L’optimisation des techniques d’assistance rend l’ablation en zones à risque plus sûres et efficaces. L’IO-RFA étend les perspectives thérapeutiques aux formes complexes ou multifocales, alliant précision chirurgicale et préservation hépatique. Ces avancées repoussent les frontières des indications curatives et ouvrent la voie à une prise en charge du CHC toujours plus personnalisée.
