Retour sur les techniques du scanner spectral à comptage photonique
A l’heure où l’innovation technologique médicale ne cesse de croître, le scanner spectral à comptage photonique, aujourd'hui au stade de première commercialisation, vient révolutionner l’imagerie TDM aux rayons X [1]. Ces scanners sont basés sur l'implémentation de nouveaux détecteurs dits à comptage photonique (PCD en anglais pour photon-counting detectors) qui ont pour but d'améliorer les principales limites majeures des actuels détecteurs dits à intégration (EID en anglais pour Energy Integrating Detectors): (A) une résolution spatiale limitée proche du centimètre, (B) un contraste souvent insuffisant au sein des tissus mous, (C) une imagerie non spécifique des tissus à atténuation proche tels que pour le calcium et l'iode, (D) une quantification non absolue des tissus basée sur une valeur de pixel en unité Hounsfield qui est dépendante de nombreux facteurs techniques et liés aux patients, et (E) une relative haute dose de rayons X des procédures actuelles.
Technologie
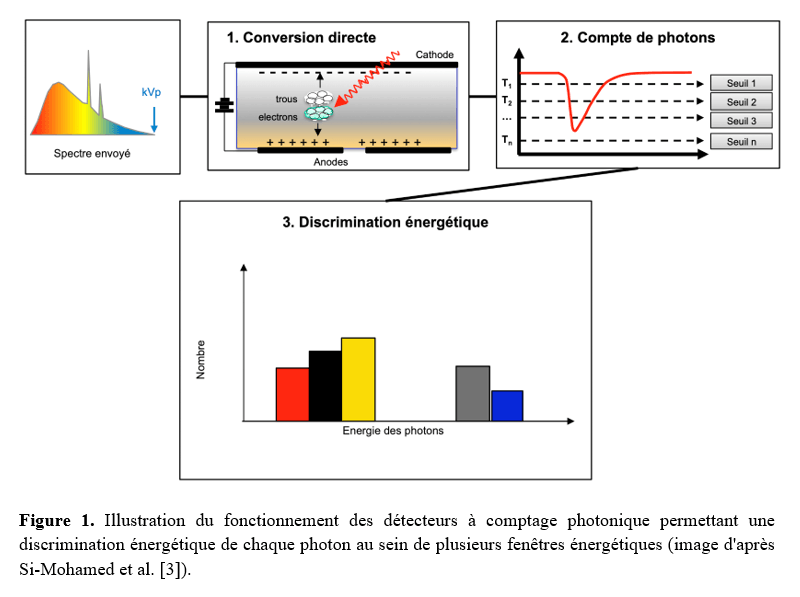
L'architecture des PCDs comprend un composant semi-conducteur d'une épaisseur de 2 à 3 mm absorbant l'énergie utilisée, c'est-à-dire entre 20 et 140-150 keV. Les détecteurs sont assemblés en une couche présentant des anodes pixélisées. Les détecteurs sont fabriqués à partir soit de tellurure de cadmium (CdTe), soit tellurure de zinc-cadmium (CZT), soit silicium (Si), des matériaux également retrouvés dans les détecteurs à intégration [1, 2]. Cependant dans les PCDs, cette couche d'anode est reliée et connectée à un circuit intégré (en anglais ASICs pour Application-Specific Integrated Circuit). Ce dernier est composé de canaux montés en parallèle qui vont successivement amplifier le signal, modéliser l'impulsion, comparer et classer les énergies en fonction des fenêtres énergétiques du système.
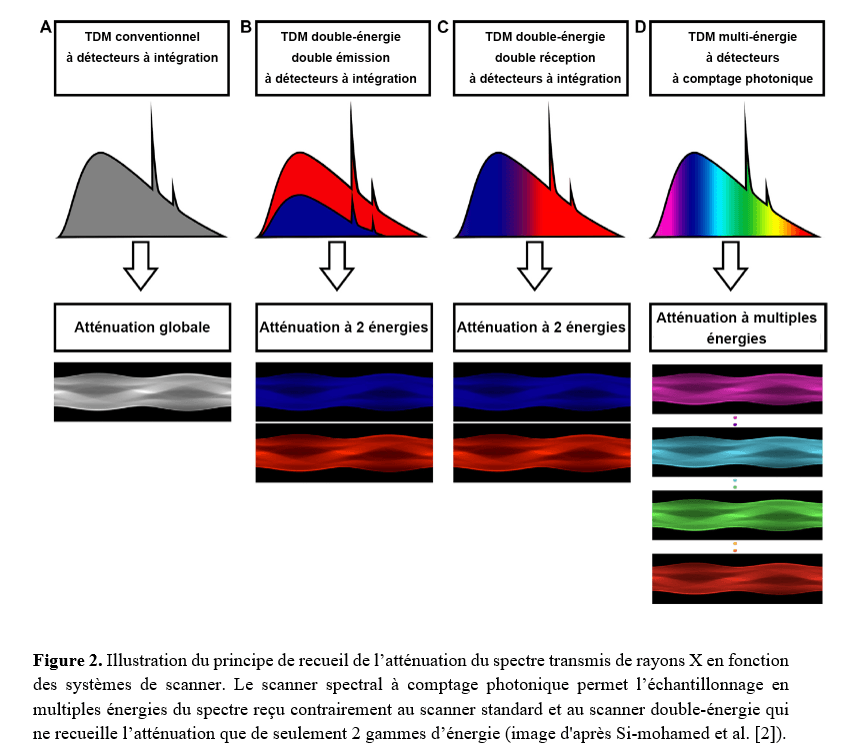
Ces détecteurs ont une capacité de discrimination énergétique basée sur l'analyse de l'énergie des photons recueillis, par l'intermédiaire de la mesure de hauteur d'une "impulsion" ("pulse" en anglais), cette dernière étant le résultat de l'interaction entre le photon transmis et le semi-conducteur constituant les PCDs, via le phénomène de création de paires électron-trou (Figure 1). Ainsi ces détecteurs comptent le nombre de photons transmis, les classant dans deux à huit fenêtres énergétiques en fonction des constructeurs, apportant un échantillonnage plus complet et précis de l'information spectrale en comparaison avec la TDM double-énergie (Figure 2).
Avantages techniques
Parmi les principaux avantages de l'imagerie TDM spectrale à comptage photonique figurent :
a) amélioration de la résolution spatiale permise grâce à la taille des pixels des PCDs de l'ordre de 200–500 µm, contrastant avec la taille élémentaire des détecteurs à intégration de l'ordre de 600–1400 µm. Cette caractéristique technologique est nécessaire afin de pallier au flux important des photons reçu par chaque pixel (de l'ordre de 106 à 7 s−1/ mm−2 pour l'imagerie thoracique par exemple).
b) amélioration de la résolution en contraste permise grâce à une plus importante pondération des photons de basse énergie transmettant l'effet photoélectrique ainsi qu'à la réduction du bruit électronique, en comparaison avec les détecteurs à intégration.
c) optimisation des doses de rayons X permise grâce à l'amélioration du rendement des détecteurs PCD et de l'augmentation du contraste des tissus.
d) imagerie couleur, se définissant comme une imagerie spécifique et quantitative différenciant un (imagerie mono-couleur) ou deux (imagerie dite bi-couleur) ou plusieurs agents de contraste (imagerie dite multi-couleur) au sein d'un même tissu et même voxel. Celle-ci est rendue possible par le système de détection des PCDs capable d'identifier de manière spécifique des tissus exogènes grâce à leur signature spectrale du K-edge, défini comme l'énergie de liaison entre la couche électronique K et le noyau de l'atome, pour aboutir à une imagerie de type moléculaire "froide" en opposition avec l'imagerie moléculaire "chaude" en médecine nucléaire [2]
Impacts escomptés
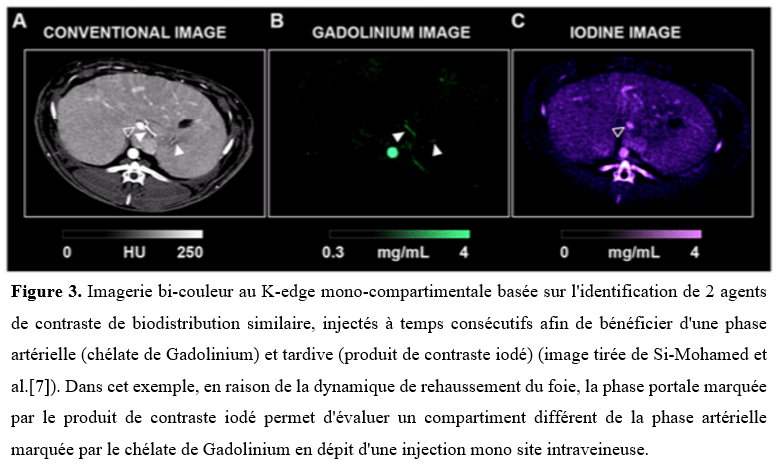
Les premières études de faisabilité in vitro et in vivo ont confirmé les promesses techniques que le scanner spectral à comptage photonique pouvait offrir au sein de plusieurs spécialités d'organe. Ces études ont particulièrement démontré les performances améliorées pour la détection, visualisation et caractérisation de structures de petite taille telles que pour l'imagerie coronarienne et pulmonaire [3–6] tout en proposant des protocoles à plus faible dose de rayons X que ceux en imagerie standard [3]. Cette technologie a aussi mis en évidence un impact bénéfique sur la confiance diagnostique que pouvait attribuer un radiologue à un diagnostic, tel que pour le diagnostic de coronaropathie ou de nodule pulmonaire [4, 6]. Enfin, et ce de manière plus innovante, cette technologie permettrait de repousser les limites de l'imagerie aux rayons X grâce à l'exploitation de l'imagerie spécifique et quantitative au K-edge pour des applications jusqu'alors inexplorées. On peut citer par exemple l'exploration au K-edge dite bi-couleur du parenchyme hépatique (Figure 3) ou des endofuites aortiques grâce à l'utilisation de 2 agents de contraste simultanément [7, 8], tout comme l'imagerie moléculaire du macrophage en combinaison avec des nanoparticules d'or au sein du foie ou de la plaque d'athérosclérose [9, 10] ainsi que l'imagerie de la thérapie cellulaire ou de celle d'agents thérapeutiques pour permettre une imagerie théranostique [11]
Points clés
Avantages potentiels du scanner spectral à comptage photonique
• Amélioration de la résolution spatiale
• Amélioration de la résolution en contraste
• Diminution du bruit électronique
• Réduction des doses de rayons X
• Identification spécifique et quantitative d'un agent de contraste basée sur son énergie K-edge
Références
1. Greffier J, Villani N, Defez D, et al (2022) Spectral CT imaging: Technical principles of dual-energy CT and multi-energy photon-counting CT. Diagn Interv Imaging S2211-5684(22)00221–2. https://doi.org/10.1016/j.diii.2022.11.003
2. Si-Mohamed S, Bar-Ness D, Sigovan M, et al (2017) Review of an initial experience with an experimental spectral photon-counting computed tomography system. Nucl Instrum Methods Phys Res Sect Accel Spectrometers Detect Assoc Equip 873:27–35. https://doi.org/10.1016/j.nima.2017.04.014
3. Si-Mohamed S, Boccalini S, Rodesch P-A, et al (2021) Feasibility of lung imaging with a large field-of-view spectral photon-counting CT system. Diagn Interv Imaging 102:305–312. https://doi.org/10.1016/j.diii.2021.01.001
4. Si-Mohamed S, Boccalini S, Lacombe H, et al (2022) Coronary CT Angiography with Photon-counting CT: First-In-Human Results. Radiology 303:303–313. https://doi.org/10.1148/radiol.211780
5. Boccalini S, Si-Mohamed SA, Lacombe H, et al (2021) First In-Human Results of Computed Tomography Angiography for Coronary Stent Assessment With a Spectral Photon Counting Computed Tomography. Invest Radiol 57:212–221. https://doi.org/10.1097/RLI.0000000000000835
6. Symons R, Pourmorteza A, Sandfort V, et al (2017) Feasibility of dose-reduced chest CT with photon-counting detectors: initial results in humans. Radiology 285:980–989. https://doi.org/10.1148/radiol.2017162587
7. Si-Mohamed S, Tatard-Leitman V, Laugerette A, et al (2019) Spectral Photon-Counting Computed Tomography (SPCCT): in-vivo single-acquisition multi-phase liver imaging with a dual contrast agent protocol. Sci Rep 9:8458. https://doi.org/10.1038/s41598-019-44821-z
8. Cosset B, Sigovan M, Boccalini S, et al (2022) Bicolor K-edge spectral photon-counting CT imaging for the diagnosis of thoracic endoleaks: a dynamic phantom study. Diagn Interv Imaging
9. Si-Mohamed SA, Sigovan M, Hsu JC, et al (2021) In Vivo Molecular K-Edge Imaging of Atherosclerotic Plaque Using Photon-counting CT. Radiology 300:98–107. https://doi.org/10.1148/radiol.2021203968
10. Si-Mohamed S, Cormode DP, Bar-Ness D, et al (2017) Evaluation of spectral photon counting computed tomography K-edge imaging for determination of gold nanoparticle biodistribution in vivo. Nanoscale 9:18246–18257. https://doi.org/10.1039/c7nr01153a
11. Tavakoli C, Cuccione E, Dumot C, et al (2023) High-resolution synchrotron K-edge subtraction CT allows tracking and quantifying therapeutic cells and their scaffold in a rat model of focal cerebral injury and can serve as a reference for spectral photon counting CT. NanoTheranostics
Salim A. Si-Mohamed, MD, PhD1,2, Sara Boccalini, MD, PhD1,2, Loic Boussel, MD, PhD1,3, Philippe C. Douek, MD, PhD1,2
Affiliations :
1. Université Claude Bernard Lyon 1, CREATIS, CNRS UMR 5220, INSERM U1206, INSA-Lyon, France
2. Département d’Imagerie cardiovasculaire et thoracique, Centre Hospitalier Universitaire Louis Pradel, Hospices Civils de Lyon, France
3. Département d’Imagerie cardiovasculaire et thoracique, Centre Hospitalier Universitaire la Croix Rousse, Hospices Civils de Lyon, France

