IRM 7T en neuroradiologie : un nouvel outil diagnostique décisif en pratique clinique
Elle bénéficie par comparaison avec les IRM conventionnelles, d’une augmentation du rapport signal et contraste sur bruit, et donc de la résolution spatiale, spectrale, et de l’effet de susceptibilité magnétique. Ces avantages sont accompagnés de quelques difficultés. La durée d’acquisition est plus longue si l’on veut pleinement profiter de l’augmentation de résolution. L’augmentation de l’effet de susceptibilité magnétique et d’inhomogénéité du B1 peuvent limiter l’analyse des structures proches de la base du crane ou dans la fosse postérieure[1]. Cependant, grâce aux progrès technologiques constants[2] ces inconvénients sont de mieux en mieux maitrisés.
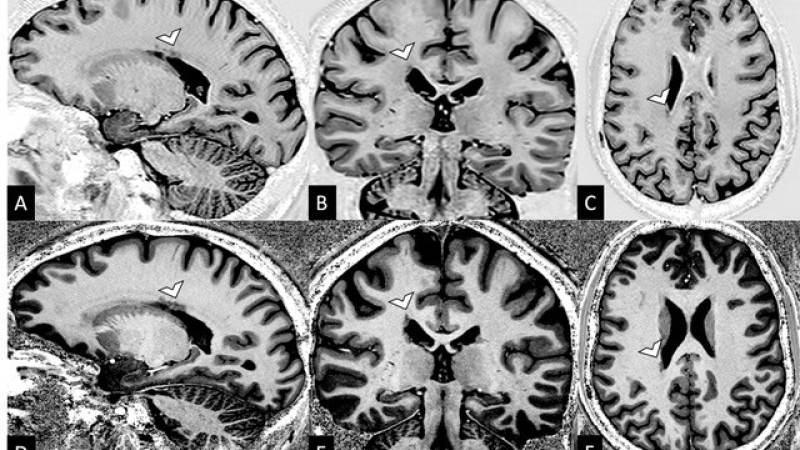
Figure 1 : Foyer d’hétérotopies péri ventriculaires droites en IRM 3T et 7T
Foyer d’hétérotopies péri ventriculaires difficilement distinguable en IRM 3T sur une séquence 3D Inversion Récupération dans le plan sagittal (A), coronal (B) et axial (C) et facilement visible en IRM 7T en séquence T1 MP2RAGE Uni dans les mêmes plans (D-E-F).
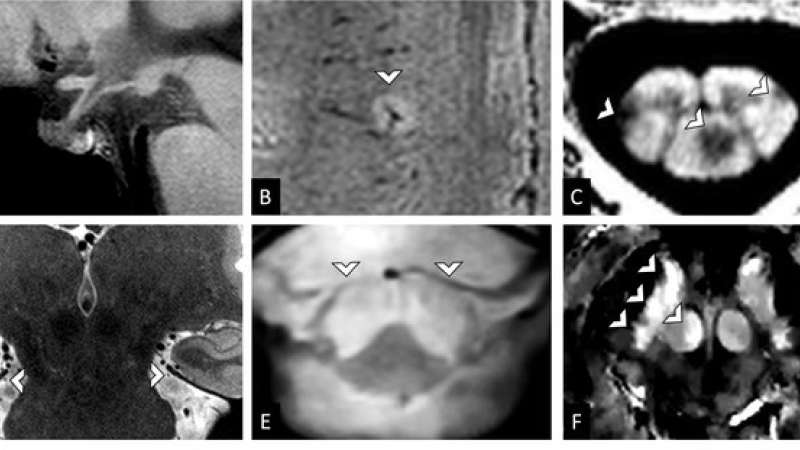
Figure 2 : Exemples d’utilisation de l’IRM 7T en neuroradiologie
(A) Séquence 3D T1 Space haute résolution dans le plan sagittal sur l’hypophyse avec une parfaite délimitation des récessus du V3, de la tige pituitaire, de l’ante et de la post-hypophyse (B) Signe de la veine centrale sur une séquence SWI dans un contexte de SEP (C) Lésions de SEP médullaires cervicales sur une séquence T1 MP2RAGE Uni haute résolution (D) Séquence coronale T2 TSE haute résolution qui montre le trajet cisternal des nerfs trochléaires (E) Hypersignaux T2* des voies motrices de la moelle cervicale dans un contexte de sclérose latérale amyotrophique (F) Excès de fer dans la substance noire et le noyau rouge à droite sur une séquence QSM, dans le plan axial, dans un contexte de maladie de Parkinson.
L’histoire clinique de l’IRM 7T a débuté avec l’épilepsie focale. L’origine malformative cérébrale est fréquente et les lésions structurales à rechercher peuvent être subtiles. Grace à sa résolution élevée, l’IRM 7T apporte une plus-value d’environ 30% par rapport à l’IRM 3T[3] (figure 1). L’IRM 7T est à présent indiquée dans les épilepsies focales pharmaco-résistantes notamment en cas d’IRM 3T négative ou douteuse[4]. Par ailleurs, l’IRM 7T est en train de trouver sa place dans de nombreuses applications émergentes (figure 2) comme la détection d’adénomes hypophysaires dans la maladie de Cushing[5], la pathologie vasculaire (caractérisation d’anévrisme ou des petits vaisseaux)[6], elle devient une technique de repérage plus fiable en radiochirurgie stéréotaxique[7], elle révèle plus de lésions corticales et médullaires dans les pathologies inflammatoires et permet de distinguer avec plus de faciliter la scléroses en plaques d’autres pathologies à la sémiologie parfois proche[8]. Elle permet d’accéder à une anatomie jusqu’alors difficile comme l’exploration du nerf crânien trochléaire[9]. La valeur ajoutée concerne aussi l’exploration de la moelle épinière[10]. Cependant, il n’existe pas à ce jour d’antenne avec un marquage CE permettant une pratique clinique de routine. En parallèle, l’IRM 7T constitue un outil précieux pour les neurosciences et la recherche clinique avec le développement d’une imagerie quantitative multi modale à haute résolution (quantification du fer, temps de relaxation, tenseur de diffusion, quantification de la myéline, IRM fonctionnelle laminaire, spectroscopie) en utilisant le proton et d’autres noyaux notamment le sodium. Les résultats offrent des perspectives particulièrement intéressantes dans l’épilepsie[11,12], les pathologies neurodégénératives[13], inflammatoires ou tumorales (biopsie virtuelle).
Certaines limites à l’utilisation clinique persistent. Les informations sur la compatibilité des implants médicaux sont limitées. Il est nécessaire de procéder de manière individuelle et avec prudence pour éliminer les contre-indications. Pour des raisons de SAR, il est contre indiqué de réaliser une IRM chez un sujet de moins de 30kg. Cependant, certaines équipes ont cependant démontré la faisabilité de l’IRM 7T chez le nouveau-né[14]. Concernant l’expérience patient, l’examen est très bien toléré en dehors de possibles vertiges. Dans notre expérience et celle de la littérature, il est rarissime qu’ils entrainent un arrêt de l’examen.
Il est aujourd’hui possible d’intégrer l’IRM 7T comme un outil d’imagerie décisif dans la pratique clinique en neuroradiologie.
Références
[1] Ladd ME, Bachert P, Meyerspeer M, Moser E, Nagel AM, Norris DG, et al. Pros and cons of ultra-high-field MRI/MRS for human application. Progress in Nuclear Magnetic Resonance Spectroscopy 2018;109:1–50. https://doi.org/10.1016/j.pnmrs.2018.06.001.
[2] Padormo F, Beqiri A, Hajnal JV, Malik SJ. Parallel transmission for ultrahigh‐field imaging. NMR in Biomedicine 2016;29:1145–61. https://doi.org/10.1002/nbm.3313.
[3] Park JE, Cheong E-N, Jung DE, Shim WH, Lee JS. Utility of 7 Tesla Magnetic Resonance Imaging in Patients With Epilepsy: A Systematic Review and Meta-Analysis. Front Neurol 2021;12:621936. https://doi.org/10.3389/fneur.2021.621936.
[4] Opheim G, Van Der Kolk A, Bloch KM, Colon AJ, Davis KA, Henry TR, et al. 7T Epilepsy Task Force Consensus Recommendations on the Use of 7T MRI in Clinical Practice. Neurology 2021;96:327–41. https://doi.org/10.1212/WNL.0000000000011413.
[5] Mark IT, Welker K, Erickson D, Johnson DR, Bathla G, Messina S, et al. 7T MRI for Cushing’s Disease: A Single Institutional Experience and Literature Review. AJNR Am J Neuroradiol 2024:ajnr.A8209. https://doi.org/10.3174/ajnr.A8209.
[6] Radojewski P, Slotboom J, Joseph A, Wiest R, Mordasini P. Clinical Implementation of 7T MRI for the Identification of Incidental Intracranial Aneurysms versus Anatomic Variants. AJNR Am J Neuroradiol 2021;42:2172–4. https://doi.org/10.3174/ajnr.A7331.
[7] Duchin Y, Abosch A, Yacoub E, Sapiro G, Harel N. Feasibility of Using Ultra-High Field (7 T) MRI for Clinical Surgical Targeting. PLoS ONE 2012;7:e37328. https://doi.org/10.1371/journal.pone.0037328.
[8] Bruschi N, Boffa G, Inglese M. Ultra-high-field 7-T MRI in multiple sclerosis and other demyelinating diseases: from pathology to clinical practice. Eur Radiol Exp 2020;4:59. https://doi.org/10.1186/s41747-020-00186-x.
[9] Testud B, Carle X, Costes C, Hak J-F, Guye M. Added Value of Ultrahigh-Resolution 7T MRI in Dural Arteriovenous Fistulas. Stroke 2024;55. https://doi.org/10.1161/STROKEAHA.123.045930.
[10] Testud B, Fabiani N, Demortière S, Mchinda S, Medina NL, Pelletier J, et al. Contribution of the MP2RAGE 7T Sequence in MS Lesions of the Cervical Spinal Cord. AJNR Am J Neuroradiol 2023;44:1101–7. https://doi.org/10.3174/ajnr.A7964.
[11] Haast RAM, Lau JC, Ivanov D, Menon RS, Uludağ K, Khan AR. Effects of MP2RAGE B1+ sensitivity on inter-site T1 reproducibility and hippocampal morphometry at 7T. Neuroimage 2021;224:117373. https://doi.org/10.1016/j.neuroimage.2020.117373.
[12] Azilinon M, Makhalova J, Zaaraoui W, Medina Villalon S, Viout P, Roussel T, et al. Combining sodium MRI , proton MR spectroscopic imaging, and intracerebral EEG in epilepsy. Human Brain Mapping 2023;44:825–40. https://doi.org/10.1002/hbm.26102.
[13] Grimaldi S, El Mendili MM, Zaaraoui W, Ranjeva J-P, Azulay J-P, Eusebio A, et al. Increased Sodium Concentration in Substantia Nigra in Early Parkinson’s Disease: A Preliminary Study With Ultra-High Field (7T) MRI. Front Neurol 2021;12:715618. https://doi.org/10.3389/fneur.2021.715618.
[14] Bridgen P, Tomi-Tricot R, Uus A, Cromb D, Quirke M, Almalbis J, et al. High resolution and contrast 7 tesla MR brain imaging of the neonate. Front Radiol 2024;3:1327075. https://doi.org/10.3389/fradi.2023.1327075.
